Towards Multimodal Translational Pathology Expanding from a Single Slice

浜松医科大学 光医学総合研究所
尖端生体イメージング研究部門
ナノスーツ開発研究分野
分野長
河崎 秀陽 博士(医学)
光学顕微鏡を利用した組織学的検索は、生命科学や診断医学にとって欠かせない手法である。ほとんどのホルマリン固定パラフィン包埋(FFPE)組織切片はヘマトキシリン・エオジン(HE)染色され、病理医が観察して病理診断が行われている。この手法は100年以上続けられ、膨大な知識の蓄積とともに病気の診断・分類が行われ、組織切片スライドガラスの量は天文学的な数に上っている1)。免疫組織化学染色も1940年代ころから開発され、特異的な抗体を用いてタンパク質の局在を明らかにし、現在の病理診断では欠かせない手法となっている。光学顕微鏡による観察は迅速・簡便で、色彩豊か(カラー)であることが特徴だが、解像度は比較的低い。
透過型電子顕微鏡(TEM)を中心とする超微細形態情報は、確定診断、疾患の進行度や予後の判定において重要な意義を持つ。しかし、電子顕微鏡観察には様々なデメリットがある。HE染色と同一切片による光-電子相関顕微鏡法(Correlative light and electron microscopy: CLEM)画像を取得しようとすると、トリミングや特殊な染色などで不可逆的に組織切片を取り扱わなくてはならない、専門的な知識と技術が必要、観察までに時間がかかる、病変の同定が難しい、電顕画像の解析が容易ではない、などの理由で実際の医療現場では電顕診断が普及していない。世界に膨大に存在するHE染色を中心としたFFPE切片を、非破壊的かつ可逆的に電子顕微鏡観察する方法は今までなかった。
筆者は生物適合性高分子溶液(ナノスーツ液)と走査型電子顕微鏡(SEM)を使用して、光学顕微鏡で同定した組織切片病変を「非破壊的」かつ「高解像で立体的」に観察することに成功した2)。この方法により、世界中に現存する膨大な病理標本を失うことなく、同一切片同一部位のマルチモードな光-電子相関顕微鏡法CLEM観察への道が開かれた。本稿では、(株)日立ハイテクの電界照射型電子顕微鏡(Field Emission-scanning electron microscopy, 以下FE-SEMと略)(S-4800)と卓上型の低真空走査電子顕微鏡(Low-vacuum Scanning Electron Microscope, 以下LV-SEMと略)(TM4000)を利用した報告例を紹介し、同一切片から広がる「マルチモードなtranslational pathologyに向けた」技術の可能性について述べる。両SEM機器とも、スライドガラスを破壊せず(切断せず)にそのまま使用できる大きなチャンバーを備えていたことは、これから紹介する技術の発展を加速させる大きな要因となった。
ナノスーツ法は、浜松医科大学で独自に開発された技術で、試料周辺にナノ薄膜を短時間で形成することにより、生きたままの高分解能SEM観察を可能にする方法である。針山らは、ショウジョウバエの幼虫が細胞外に分泌し体表面を保護する粘性の細胞外物質(ECS: Extra Cellular Substance)に電子線やプラズマを照射することで、高真空下環境下でも乾燥することなく生きた状態でSEM観察が可能であることを発見した3)。電子線あるいはプラズマ照射によってECSが重合することでナノ薄膜が形成され、生体内部に含まれる気体や液体が高真空環境下でも保持されたためである。
バイオミメティクス的発想から、ECSを模倣する界面活性剤などの生体適合性物質を選択し、プラズマ重合することで生体表面にナノ薄膜を形成する技術が開発された。これにより、生物の表面微細構造や運動をSEM内で生きたまま観察することが可能になった。また、グリセリンなどを主成分とするSurface Shield Enhancer(SSE)の開発にも成功した4)。このSSEは生体親和性があり、細胞や組織でも使いやすい溶液であり、薄膜でも蒸発を防ぎ、導電性を確保するため様々な研究分野に応用が可能である。
病理診断では光学顕微鏡で同定した部位をより高倍で観察する必要が生じることがあり、最近では超解像蛍光顕微鏡を使用して大腸癌5)や乳癌6)のFFPE切片解析の報告がある。しかしこの方法は蛍光染色が必須の条件のため一般のHE染色切片には応用できない。そのために超高倍率の観察には電子顕微鏡は不可欠なツールである。最近ではLV-SEMを利用して、腎臓を中心としたパラフィン切片の解析が行われるようになり、腎生検LV-SEM研究会での活発な議論がなされている。従来法では、既存のHE染色組織切片をそのままSEM観察することは通常なく、連続切片を金・炭素・オスミウム蒸着処理し導電性付与後に不可逆的に電子顕微鏡観察する。通常の蒸着処理では切片が完全に乾燥してしまい本来の含水状態の組織構築は失われてしまう。更に一度蒸着・乾燥した切片にHE再染色すると色合いが変化してしまい、元の状態に戻すことが困難であった。しかし、ナノスーツ液を利用することで、これらの問題を解決する糸口が開かれた。
同一切片同一部位を観察する際、SEM像は高倍率かつモノクロであるため、同一病変部位を見つけるまでに多くの時間と労力を必要とする。それを解決するためには切片に位置情報の付与が必要である。その行程は以下の通りである。組織切片上の関心のある箇所を特定、ガラスの裏面にマーキング後、光学顕微鏡による病変部デジタル画像を取得する。カバーガラスをキシレンで外し、親水化後にナノスーツ液を塗布し、スピンコートで薄膜化する。薄膜形成後は特定した部位周辺に別途高濃度ナノスーツ液を滴下しマーキングする2)。この方法でSEMに移動しても容易に関心のある同一箇所を見つけることができる。以上の作業により既存のHE標本を簡便にCLEM観察することが可能となる(図1A)。
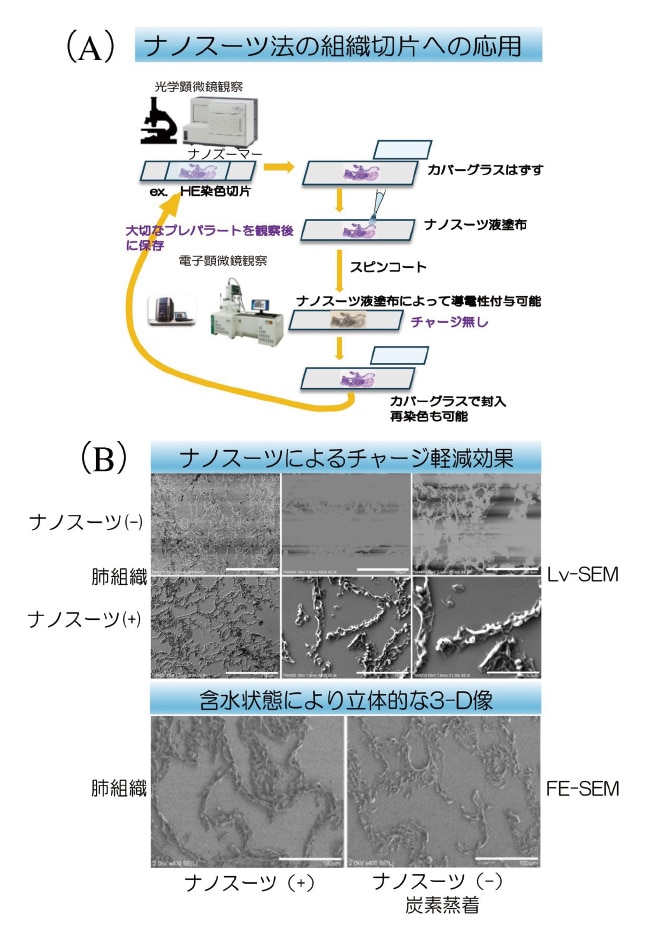
図1 FFPE切片におけるナノスーツ-CLEM法
A:ナノスーツ-CLEM法の作業手順。
B:ナノスーツによるチャージ軽減効果(LV-SEM)と含水状態組織像(FE-SEM)(二次電子モード)。
Lab Invest. 2020;100(1):161-173.の図を改変。CC-BY-4.0の下で使用2)。
ナノスーツ膜は絶縁体であるガラス上にある組織切片に導電性を付与するためチャージ(帯電現象)軽減効果がある。これにより、よりクリアで高分解能なSEM画像を得ることができ、含水状態の組織像を観察することができる(図1B)。またSEM観察後でもナノスーツ液によるマーキングも除去できるなど同一切片を非破壊的に扱い、切片をもとの状態に戻すことができ、貴重な切片を失わないという利点がある。また光学顕微鏡像は二次元カラー像であり、同一切片の三次元情報と比較検討することで、新しい知見を得ることが容易になる。この技術は特許出願後(特許第7089756号)に論文発表し「advanced in translational pathology」の一つとして紹介された2)。
病理診断では光学顕微鏡で同定した部位をより高倍で観察する必要が生じることがある。ウイルスやある種の細菌は光学顕微鏡では病原体としてとらえることができないほど小さく、電子顕微鏡を用いた高倍率観察を必要とする場合がある。このため、ナノスーツ-CLEM法を用いて真菌、細菌、ウイルスを観察した。
まずアスペルギルス肺患者の標本を光学顕微鏡とFE-SEMを用いてナノスーツ-CLEM法で比較検討した。光学顕微鏡で観察されたアスペルギルス菌体やその周囲の淡い好酸性フィブリン様物質(図2A)は、SEMの二次電子モード(SEモード)によって明瞭かつ立体的に視覚化でき、その拡大像では胞子嚢、細胞壁、中隔、核の立体構造が描出された(図2B, C)。また、細菌コロニーの同定に難渋することがあるが(図2D)、ナノスーツ-CLEM法を利用して細菌塊の部分を観察すると立体的な桿菌の集合像が認められた(図2E, F)。これは培養検査によりAeromonas hydrophilaと同定された。さらに、本法は光学顕微鏡では可視化不可能なウイルス粒子の同定に強力なツールとなる。サイトメガロウイルス(CMV)感染患者の腎臓に生じた巨細胞封入体(図2G)の付近には、CMVに相当する粒子(100〜300 nm)が多数見られた(図2 H, I:白矢印)。
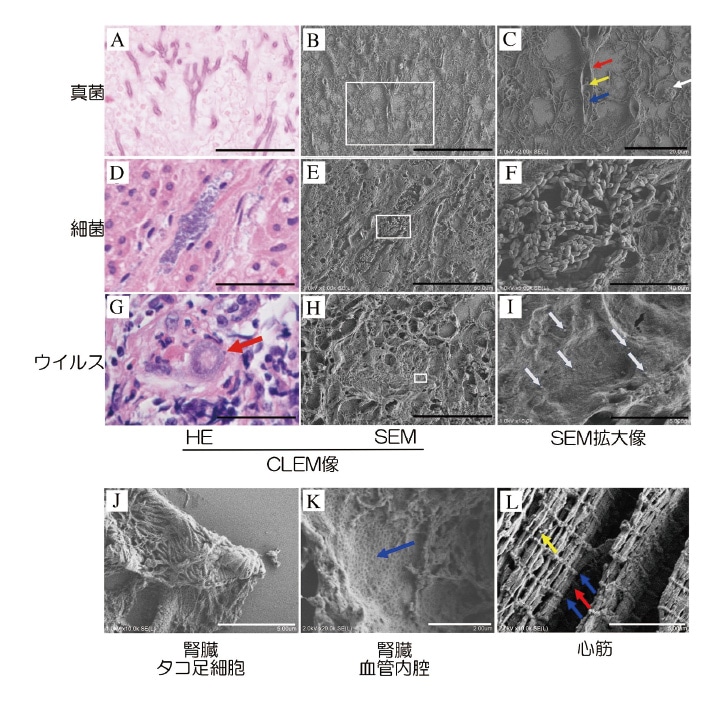
図2 FFPE切片におけるCLEM高解像SEM像(二次電子モード)
A-C:肺アスペルギルス、A: HE像、B:AのCLEM-SEM像、C:B□部分を拡大SEM像、白矢印:胞子、赤矢印:細胞壁、青矢印:隔壁、黄矢印:核。D-F:細菌(Aeromonas hydrophila)、D: HE像、E:DのCLEMSEM像、F:E□部分を拡大SEM像。G-I:サイトメガロウイルス(CMV)、G: CMV巨細胞封入体HE像(赤矢印)、H:GのCLEM-SEM像、I:H□部分を拡大SEM像、CMV粒子(白矢印)。J:腎臓糸球体タコ足細胞。K:腎臓血管内皮表面、青矢印陥凹部。L:心筋の組織微細構造像、M line(赤矢印)、Z line(青矢印)、ミトコンドリア(黄矢印)。Lab Invest. 2020;100(1):161-173.の図を改変。CC-BY-4.0の下で使用2)。
病原体以外にも光学顕微鏡でとらえた病変の微細構造を観察する必要性は常にある。我々はナノスーツ-CLEM法により光学顕微鏡ではとらえることができない同一切片同一部位の組織微細構造を観察できることを報告した。具体的には、腎臓糸球体タコ足細胞(図2J)や有窓毛細血管の凹凸構造(図2K)も明瞭に描出できた。心筋線維を観察すると筋原線維の線条パターン(Iバンド内Z lineとAバンド内M line)および球状ミトコンドリアの立体像をとらえることができた(図2L)。またここでは示さないが、光学顕微鏡では不明瞭な細胞突起構造、細胞質内空胞、組織間線維などの明瞭な立体組織像の観察にも成功している。さらにヒト唾液腺腫瘍7)、肺小細胞癌8)には一次繊毛を有するものがあることを、免疫組織化学的解析とナノスーツ-CLEM法を用いて明らかにした。
しばしばFFPE組織切片の作成過程では固定、パラフィン包埋、親水化、脱水を繰り返し、場所によって微細構造が破壊されている部分がある。壊死部分を避け、十分に固定され、パラフィン充填されている場所であれば微細構造が保持され、走査型電子顕微鏡で確認できる。本法により様々な疾患の微細構造変化をナノスーツ-CLEM法により発見できる可能性があり、新たな病理機序の解明につながると期待される。
病理診断において、免疫染色はタンパク発現部位検出するための常套手段となっている。その発色のほとんどはDAB(3,3'-ジアミノベンジジン)染色で行われている。塩化金やオスミウム酸(OsO4)は高親和性にDABに結合することができるため、DAB染色部位を重金属で増感することが可能である。ナノスーツ膜は電子線をある程度透過させることができるため、SEM観察でDAB/塩化金やDAB/OsO4陽性部位を反射電子(後方反乱電子、backscattered electron(BSE))像で高コントラスト領域として観察することができる。
我々の研究室はFFPE切片におけるHuman papilloma virus9, 10), CMV9), Varicella-Zoster virus(VZV)9), SARSCoV-2(unpublished)のウイルス粒子構成蛋白に対して免疫染色を行いDAB発色をおこなった。その後2% OsO4をDABと反応させ、FE-SEMでDAB/OsO4陽性部位を観察した。図3にはVZVウイルス粒子の観察例を示す。VZV感染患者の皮膚水疱病変部および表皮下領域にVZV抗原陽性(DAB陽性)となった(図3A)。ナノスーツ-CLEM法を用いたSEM観察ではDAB/OsO4領域がBSE modeで白色領域として強調された(図3B)。拡大された領域には複数の白い点のスポットが見られ(図3C)、拡大画像には複数の粒子(矢頭)(図3D、E)が含まれていた。DAB/OsO4染色陰性領域にはウイルス粒子様構造は見られなかった。形状、直径(150-200 nm)、および電子増強信号(矢頭)の特徴からVZV粒子と判断された。オスミウムコートでもVZV粒子(矢頭)は描出されたが、ややコントラストが低いことが示された(図3F)。図3Cに対応するCLEM-TEM画像には複数のVZV粒子が観察される(図3G、H)。また水疱上皮表面にも、複数の孤立したVZV粒子(矢頭)が二次電子モード(図3I)で見られると同時に、BSEモード(図3J)でもDAB/OsO4で強調されたVZV粒子が見られた(矢頭)9)。
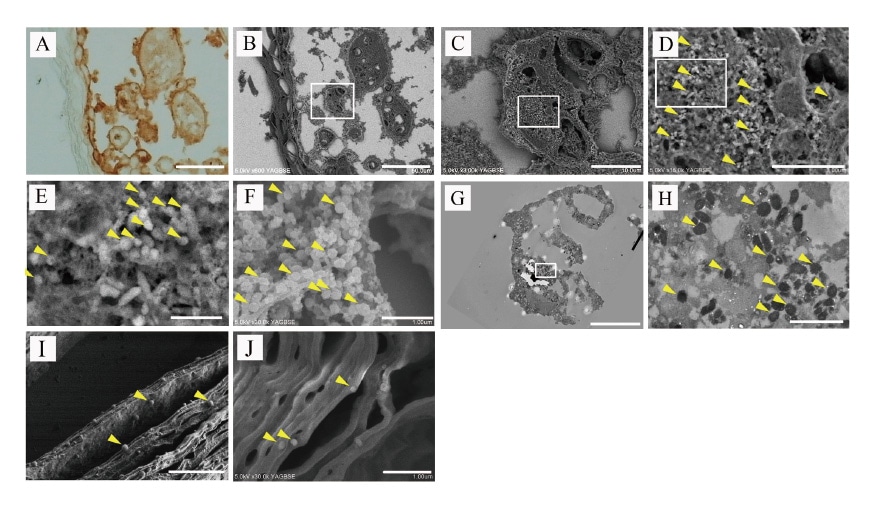
図3 Varicella-Zoster virus(VZV)の免疫染色CLEM像
A:VZV陽性DAB光顕像。B:AのCLEM-SEM像(反射電子モード(BSEモード))。DAB領域強調像(白色領域)。C:Bの□拡大像。D:Cの□拡大像。ウイルス粒子(黄矢頭)。E:Dの□拡大像。VZV粒子(黄矢印)。F:オスミウムコーティング像。G:Cに対応するCLEM TEM像。H:Gの拡大像。複数のVZV粒子(黄矢頭)。I:表皮上の複数の孤立したVZV粒子(黄矢頭)。VZV粒子(黄矢頭)(二次電子モード)。J:DAB/OsO4で強調された表皮上の複数の孤立したVZV粒子(黄矢頭)(BSEモード)。Lab Invest. 2023;103(1):100020の図を改変。CC-BY-4.0の下で使用9)。
SEMは電子線を利用して試料表面の拡大像を観察する装置である。エネルギー分散型X線分析(EDX)装置と組み合わせて特性X線を検出することにより、特定箇所の元素分析を行うことができる。病理医はHE切片で異物沈着を発見し、その異物の元素を予想して特殊染色を行うことがある。ただし、この特殊染色は作業工程が複雑で経験が必要であり、かつ想定物質以外のものは特定できない欠点がある。ScimecaらはEDX微量分析は組織および法医学における重金属の蓄積を検索するための強力なツールとなる可能性があると報告している11)。しかし従来のTEMまたはSEMを用いたEDX法では組織切片を破壊し、貴重な標本の再評価が難しかった。今回のナノスーツ-CLEM法によって、従来の標本を破壊せずに多数の元素を一度に分析する道が開かれた2)。
その実例を以下に紹介する。まず臨床的に鉄沈着を疑うHE標本のEDX分析をおこなった。HE染色後の鉄沈着部位を特定し(図4A)、ナノスーツ法によってLV-SEMの最大電子ビーム(15 kV)を使用しても明瞭なBSE画像を撮影することができた(図4B)。SEM/EDX分析の結果、茶褐色の沈着部位に鉄(図4C)とP(図4D)が存在していることを示すことができた。

図4 FFPEにおける元素分析法
A:沈着部位(褐色)、HE染色。B:AのCLEM-SEM像(反射電子(BSE)モード)。C:鉄(白矢印)。D:P(リン)(白矢印)。E-K:肺の炭粉沈着症患者、E:HE染色、F:EのCLEM-SEM像(BSEモード)、G:アルミニウム(Al)(白矢印)、H:ケイ素(Si)(白矢印)、I:マグネシウム(Mg)(白矢印)、J:酸素(O)(白矢印)、K:炭素(C)(白矢印)。Lab Invest. 2020;100(1):161-173.の図を改変。CC-BY-4.0の下で使用2)。L-U:消化管におけるリン酸ランタン沈着。L, M:胃HE染色。N, O:十二指腸HE染色:褐色の粒状(*)、針状(矢印)、または無定形構造を示す沈着(Δ)。P, S:異物沈着部位SEM像(BSEモード)。Q, T:La(ランタン)。R, U:P(リン)。Diagnostics(Basel). 2019;10(1),1の図を改変。CC-BY4.0の下で使用12)。
次に、肺の炭粉沈着症の患者を分析した結果、HE染色標本で複数の黒〜茶褐色の沈着が観察された(図4E)。BSE像では、ほとんどの沈着部位に強い後方散乱信号があったが、一部にはなかった(図4F)。ナノスーツSEM/EDX分析により、肺組織切片に複数の元素(アルミニウム(Al)(図4G)、ケイ素(Si)(図4H)、マグネシウム(Mg)(図4I)、酸素(O)(図4J)、炭素(C)(図4K))の存在が明らかになり、多くの重金属堆積物は酸化されていたことを示していた。
さらに、消化管におけるリン酸ランタン沈着の観察を行った12)。HEスライドにおいてリン酸ランタン沈着の疑いがある症例において粒状、針状、または無定形構造を示す茶褐色の沈着物を認めた(図4L, M, N, O)。同じ領域をナノスーツ-CLEM法(BSEモード)を用いて観察したところ、色素沈着が観察された領域は、明るいコントラストを示した(図4P, S)。さらに、SEM-EDSによる元素マッピングでは、同領域にランタン(La)(図4Q, T)およびリン(P)(図4R, U)の局在が確認された。
他にも、同様の方法を用いて、FFPE切片で血清カリウム抑制剤であるポリスチレンスルホン酸カルシウムイオン交換樹脂薬剤(カリメート)の構成元素の一つである硫黄元素を検出することにより、腸管へのカリメート沈着の確定診断に用いることができることを報告した13)。カリメートが腸管沈着すると、時に腸管穿孔など重篤な症状を引き起こすため、早期確定診断し、服薬停止を促すことが重要となる。また最近、Helicobacter pylori除菌治療歴のある方では胃内に黒点が認められるのに対し、Helicobacter pylori現感染の方では黒点がほとんど認められないことがわかり、本法で胃内黒点の元素分析をおこなった結果、主な構成成分が鉄であることを世界で初めて明らかにした14)。この発見からさらに胃疾患の病態に迫り、臨床検査の開発へとつながる可能性がある。
私は病理医として、この方法を日常診断業務に頻繁に利用し、各臓器標本における異物沈着物の診断に役立てている。今後、病理診断業務においてこの方法が強力なツールとなることが期待される。
本大学で独自に開発されたナノスーツ液は、①粘稠性が低く薄膜化しやすく、導電性があるため微細構造の明瞭なSEM画像を得られやすい、②ボウフラなどの生命体を電子顕微鏡内で生命維持できるほどに組織保護作用がある、③金属元素を使用しないことから観察対象元素の邪魔にならないなど、まとめると表1のような多くの独創的な成果を得ることができる。
この新たな方法で、病理医または人工知能(AI)により同定された組織病変CLEM観察部位から、予期せぬ立体微細構造病変の発見や従来の電子顕微鏡診断の代替可能性を探索することができる可能性がある。更に電子線ダメージからの保護効果のあるナノスーツ膜の特性を生かし、同一組織切片のCLEM像と多様な分析方法の比較解析も行うことも目指している。今後、同一切片から広がるマルチモードなtranslational pathologyの可能性を追求することで、今まで見えなかったものを可視化し、微細形態構造と分子構成との関連を解明できる可能性がある。新たな知見を通して病理機序の解明や新規診断法の確立につなげ、未来の医療の発展に貢献することを期待している。
表1 FFPE切片におけるナノスーツ-SEM法で期待される技術的効果

謝辞
本研究の遂行にあたり、(株)日立ハイテクの皆様にお世話になりました。本研究は科学研究費基盤C(20K07390)のサポートにより行われました。
参考文献
登録記事数 203件
まだまだあります。